Алюминий (квасцы) — 13 элемент периодической таблицы элементов, 13 группы в современной классификации. Он обладает относительно низкой электропроводностью, но наименьшей плотностью среди других металлов. В природе алюминий встречается в виде стабильного изотопа Al27. Купить алюминий можно на нашем сайте.

Он ценится за высокую коррозийную стойкость и лёгкость. На поверхности изделий алюминия образуется тонкая оксидная плёнка оксидов, которая и защищает металл от дальнейшего окисления. Некоторые алюминиевые сплавы обладают большой твердостью, тугоплавкостью и жаропрочностью и проявляют другие полезные качества, в виду образования алюминидов (интерметаллических сплавов). Полную информацию об этом элементе смотрите в таблице, приведённой ниже.
Свойства атома |
Химические свойства |
Термодинамические свойства простого вещества |
Кристаллическая решётка простого вещества |
Прочие характеристики |
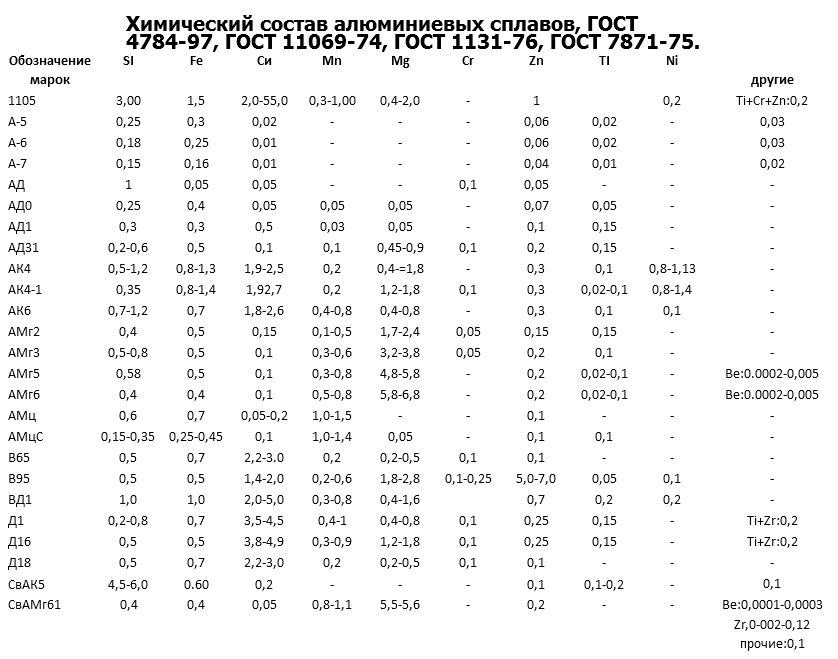
Имя, символ, номер Алюминий / Aluminium (Al), 13 |
Ковалентный радиус 121±4 пм |
Термодинамическая фаза Твёрдое вещество |
Структура решётки кубическая гранецентрированая |
Теплопроводность (300 K) 237 Вт/(м·К) |
Группа, период, блок 13, 3 |
Радиус Ван-дер-Ваальса 184 пм |
Плотность (при н. у.) 2,6989 г/см³ |
Параметры решётки 4,050 Å |
Скорость звука 5200 м/с |
Атомная масса 26,981539 а. е. м. (г/моль) |
Радиус иона 51 (+3e) пм |
Температура плавления 660 °C, 933,5 K |
Температура Дебая 394 K |
|
Электронная конфигурация [Ne] 3s2 3p1 |
Электроотрицательность 1,61 (шкала Полинга) |
Температура кипения 2518,82 °C, 2792 K |
||
Электроны по оболочкам 2, 8, 3 |
Электродный потенциал -1,66 В |
Теплота плавления 10,75 кДж/моль |
||
Радиус атома 143 пм |
Степени окисления 3, 1 и 2 — менее характерны и проявляются в газовой фазе при температуре выше 800°C |
Теплота испарения 284,1 кДж/моль |
||
Поперечное сечение захвата тепловых нейтронов 215*10-25 м2 |
Энергия ионизации 1-я: 577.5 кДж/моль (эВ) |
Молярная теплоёмкость 24,35[1] Дж/(K·моль) |
||
Молярный объём 10,0 см³/моль |
Область применения
Полуфабрикаты из алюминия:
- Алюминиевый уголок
- Алюминиевый пруток
- Алюминиевый лист
- Алюминиевая проволока
- Алюминиевая чушка
- Алюминиевая труба
- Алюминиевая плита
Алюминий применяется в строительстве, электротехнике, кораблестроении, на производстве холодильных установок, для нужд народного хозяйства. В электротехнике он применяется при изготовлении проводников, корпусов, диодов охладителей. Для защиты металлических изделий от коррозии, алюминий наносят разными способами на их поверхность. Порошок алюминия применяется при производстве металлов, сплавов, а также ячеистого бетона. Большая же часть алюминия выпускается в виде сплавов, так как чистый металл слишком мягок.
Мировые запасы и основные поставщики
Алюминий является самым распространённым металлом и четвертым по содержанию в земной коре химическим элементом (8,8%), но в чистом виде присутствет редко в кристалах размером в несколько микронов. В морской воде содержится 0,01 мг/л3, а в пресной 0,001-10 мг/л3 алюминия. Алюминий обнаружили со 100% уверенностью только в XIX в. В промышленных масштабах его начали производить во второй половине того же века. И лишь с освоением метода производства алюминия электролизом, освоенным Полем Эру (франция) и Чарльзом Холлом (США) в 1886 году, алюминиевая промышленность стала завоёвывать своё почётное второе место в производстве металлов после стальной промышленности. Однако, более 60% алюминия сейчас производится из вторсырья.
Во всех преуспевающих странах этот вид промышленности стал развиваться бурными темпами. До первой мировой войны алюминий производило 6 стран, после — 16, 1967 году — 30 стран. В России первый алюминиевый завод был построен только в 1932 году. Это связано с программой Ленина по электрификации страны и постройкой первой ГЭС на Волхове. Мировыми лидерами по производству алюминия являются: КНР, Россия, Канада, США, Австралия, Бразилия, Индия и другие.
Сырье для производства алюминия

Основным сырьём для производства алюминия являются бокситы (сложные по минеральному составу руды, различной твёрдости, обычно красноватого оттенка). В бокситах содержится 40-60 % глинозёма, который представляет собой смесь оксидов алюминия, натрия, калия и магния.
Крупнейшими производителями высококачественных бокситов являются: Австралия, Гвинея, на Ямайка, Суринам, Гайана, Югославия и другие страны. При этом 2/3 запасов сосредоточено в Гвинее, Бразилии, Австралии, на Ямайке, в Камеруне и Мали. Бокситы добываются открытым или реже закрытым способом, по различным технологическим схемам. Из них производят глинозём. Из глинозёма и производится чистый алюминий электролитическим методом.

Эру и Холл же нашли способ снизить температуру плавления оксида алюминия и энергозатраты. Так как оксид алюминия имеет температуру плавления 2050°C, то они придумали способ электролитической плавки алюминия в расплавленном криолите. С помощью этого метода стало возможным снизить температуру плавления до 950°C. Криолит — это крайне редкий в природе минерал с химическим составом Na3AlF6. Основные известные месторождения криолита сосредоточены в Западной Гренландии, на Южном Урале в Ильменских горах и в штате Колорадо (США). Этот способ производства алюминия был бы весьма дорогостоящим, если бы учёные не научились производить криолит химическим способом, при взаимодействии фторида алюминия и фторида натрия, либо взаимодействия в присутствии соды плавиковой кислоты и гидроксида алюминия.
Получение глинозёма, алюминия из глинозёма, рафинирование
В заголовке выделены основные стадии получения чистого алюминия из бокситов.
Получение глинозёма

Для получения глинозёма бокситы измельчают и смешивают с щелочью и известью. Бокситы выщелачивают при температуре около 240°C в трубчатых или круглых автоклавах в растворе щелочи, в результате чего образуется красный шлам с содержанием оксидов железа и титана и нерастворимых остатков алюмината натрия и силиката натрия. Температуру понижают до 100°C с добавлением раствора щелочи. Промывкой алюминатного раствора и шлама в сгустителях шлам и раствор разделяют. Шлам оседает, а раствор фильтруют. Фильтрованный раствор переливают в ёмкости с мешалками и понижают его температуры до 60°C. В результате перемешивания и процесса кристаллизации образуется гидроокись алюминия Al(OH). С помощью гидроциклонов и вакуумных 60% Al(OH) выпадает в осадок, часть гидроокиси возвращают для последующих операций, остаток также идёт на выщелачивание. Полученную гидроокись обезвоживают во вращающихся трубчатых печах и при температуре 1150-1300оС и получают глинозём с содержанием 30-50% α-Al2O3 (корунд) и γ-Al2O3.
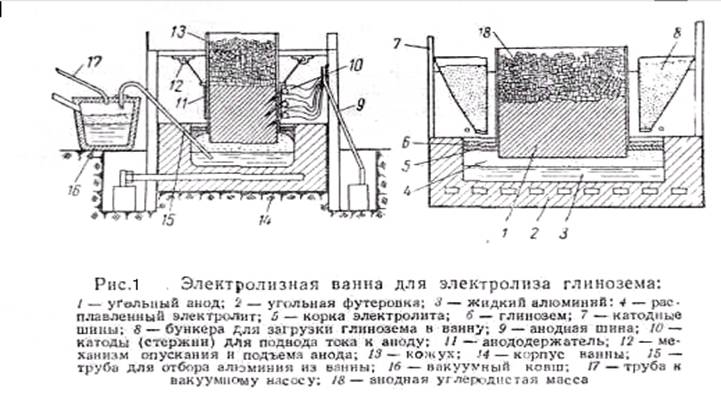
Растворённую в криолите окись алюминия подвергают процедуре электролитического восстановления при температуре около 960°C в ваннах футерованных углеродистыми блоками, которые и выступают катодами в процессе электролиза, через которые подаётся электричество. В роли анодов выступают угольные блоки подвешенные сверху в алюминиевых профилях. На анодах осаждается CO и CO2, а на подины ванны осаждается жидкий алюминий, который в процессе выпускается. Аноды в процессе электролиза выгорают.
Рафинирование
Иногда рафинирование производится путём алюмоорганических комплексных соединений и плавки. Но в основном рафинирование производится методом трёхслойного электролиза в ванных одетых стальным листом при температуре 700-800°C. Нижний анодный слой — это расплавленный алюминий, средний слой — электролит. Верхний катодный слой — чистый алюминий растворяющийся из нижнего слоя в электролите. К верхнему слою подводится графитовый стержень под напряжением. В результате кремний и тяжёлые металлы остаются в анодном слое, а весь алюминий поднимается на поверхность. Полученный сплав разливают. В среднем он содержит:
- Fe 0,0005-0,002 %
- Si 0,002-0,005 %
- Cu 0,0005-0,002 %
- Zn 0,0005-0,002 %
- следы Mg
- остальную часть составляет Al
Полученный в результате рафинирования сплав разливают в формы и получают из него слитки и чушки, которые идут на производство плит, листов, профилей, проволоки, фольги, путём ковки, волочения, проката, штамповки. А порошок получают из жидкого сплава, распыляя на него струю N2 и О2.